□ 국내 연구진이 콜레라균의 독소 발현과 관련된 단백질 간 결합 구조를 세계 최초로 분석해 병원성을 제어할 수 있는 원리를 규명했다. 향후 콜레라균의 독성 제어와 치료제 개발 등에 기여할 것으로 기대된다.
□ 한국원자력연구원(원장 주한규) 첨단방사선연구소(소장 정병엽)는 가속기동위원소연구실 김민규 박사 연구팀이 콜레라균의 독소 발현 관련 단백질을 억제하는 원리를 찾았다고 20일 밝혔다. 서울대학교 석영재 교수팀과 공동으로 연구한 결과다.
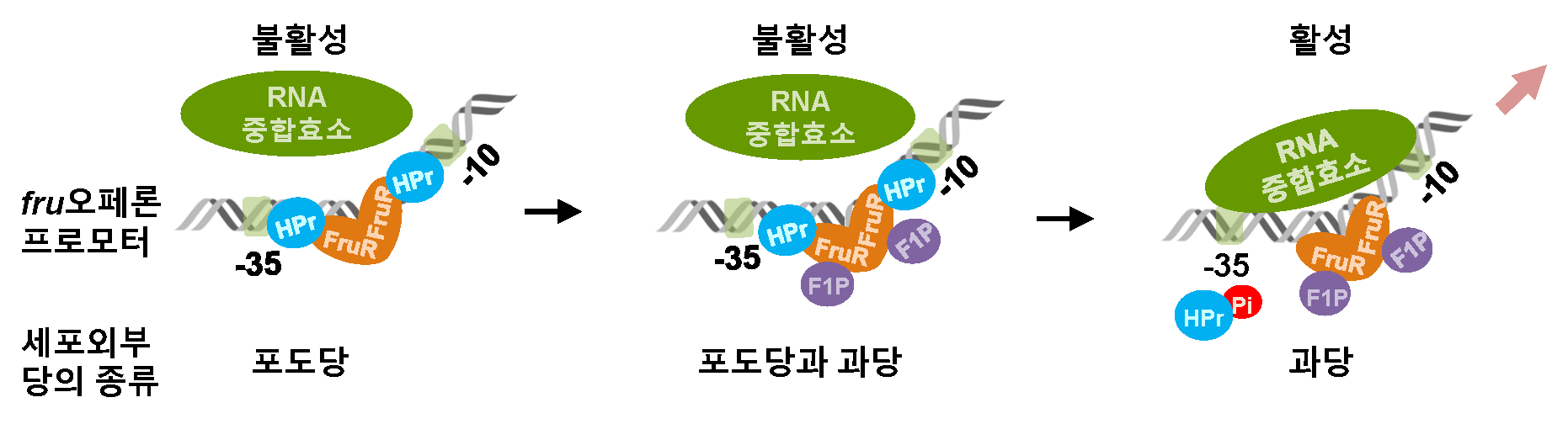
그림 1. 비브리오 콜레라균 과당 수송 단백질 발현 활성화 모식도
(상세 설명)
① 외부에 포도당만 존재 시, 탈인산화된 HPr과 FruR이 결합하여 RNA 중합효소에 의한 과당 오페론 발현이 억제된다. 그 결과, 과당 수송 단백질이 생성되지 못해 과당을 사용할 수 없게 된다.
② 포도당과 과당이 동시에 존재 시, 과당대사산물인 F1P(Fructose 1-Phosphate)가 FruR에 결합하지만, 여전히 HPr은 탈인산화 상태로 FruR과 결합하여 과당 오페론 발현이 억제된다. 그 결과, 과당 수송 단백질이 생성되지 못해 과당을 사용할 수 없게 된다.
※ 비브리오 콜레라균에서 과당은 세포 내부로 수송되면 과당대사산물로 전환됨
③ 포도당이 소진되어 과당만 존재 시, HPr이 인산화되어 FruR과 결합하지 못하고, FruR-F1P 복합체는 과당오페론 프로모터 DNA의 구조적 변형을 유도해 RNA 중합효소의 결합을 촉진한다. 이는 과당 오페론의 전사 활성을 일으킨다. 그 결과, 과당 수송 단백질 생성이 활성화돼 과당 사용이 촉진된다.
※ 오페론 : 기능적으로 연관성이 큰 일련의 단백질들을 발현하는 유전자가 밀집되어 있는 시스템으로 함께 전사가 조절되는 특징이 있음
※ 전사 : DNA의 유전정보가 복사되어 RNA로 전달되는 과정으로, RNA 중합효소에 의해 발생하며 생명을 유지·재생산하는데 핵심적인 생물학적 반응임
※ 프로모터 : 유전자의 전사를 조절하는 DNA의 특정 부위, 보통 유전자의 전사 개시 시점 주변에 위치한다
※ RNA 중합효소 : DNA를 주형으로 RNA를 합성하는 효소
□ 콜레라나 패혈증을 일으키는 고위험 병원균인 비브리오균에 감염되면 과당을 수송하는 단백질이 매우 증가한다. 이를 통해 과당 수송 단백질과 독소 생성의 관련성은 알려졌지만, 해당 단백질량을 어떻게 조절할 수 있는지는 알려지지 않았다.
□ 연구진은 과당 수송 단백질 발현을 억제하는 원리를 찾기 위해 당 대사 조절에 관여하는 단백질인 HPr(에이치피알, Histidine-containing Phosphocarrier Protein, 인산 전달계 단백질)과 FruR(프루알, Fructose Regulator, 과당 수송 단백질 활성 인자)에 주목했다. 콜레라균 주위 환경에 포도당 또는 과당이 있을 때 HPr과 FruR의 현상 변화를 관찰했다.
ㅇ 콜레라균은 포도당을 과당보다 선호하는 것으로 알려져 있다. 포도당이 있으면 HPr과 FruR이 결합해 과당 수송 단백질이 발현되지 않았다. 포도당과 과당이 함께 있을 때도 마찬가지였다. 반면, 과당만 있으면 HPr과 FruR이 분리돼 과당 수송 단백질이 발현됐다. 공동 연구진은 이 현상을 세계 최초로 확인하고 그 분자적 기전까지 규명하는 데 성공했다.
ㅇ 특히, 연구진은 이러한 HPr과 FruR의 결합 방식을 X-선 결정학을 이용해 최초로 밝혀냈다. X-선 결정학은 방사선의 일종인 X-선을 원자에 쪼일 때 나오는 회절현상을 분석해 원자 구조를 알아내는 방법이다. 단백질의 3차원 구조를 선명하게 파악할 수 있다. 이를 통해 기존 다른 균과는 구별되는 두 단백질 간의 결합 방식과 복합체의 구조적 특징들을 확인했다.
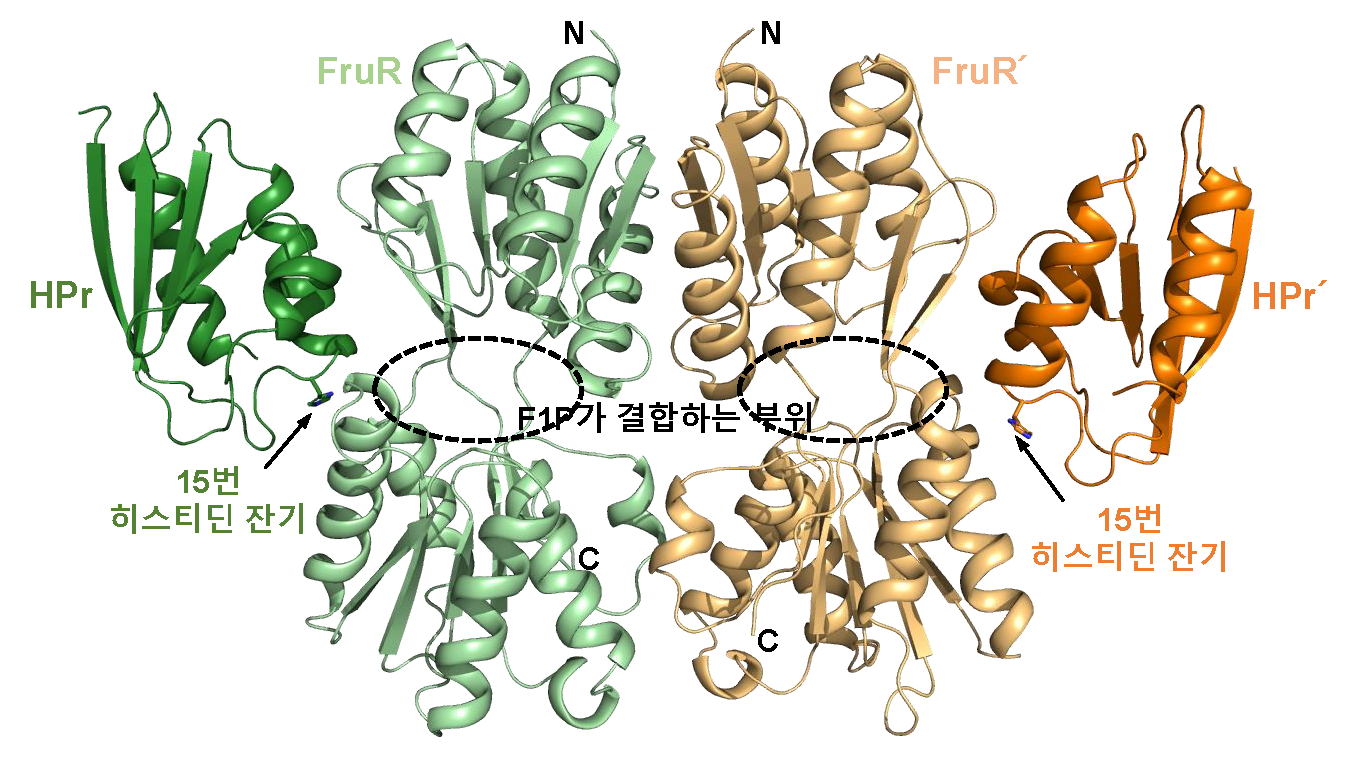
그림 2. 비브리오 콜레라균 HPr-FruR 복합체 구조
(상세 설명)
HPr-FruR 복합체 구조는 FruR 이합체에 탈인산화된 HPr 두 분자가 결합한 형태이다. HPr은 15번 히스티딘 잔기가 탈인산화된 상태에서만 FruR과 결합할 수 있다. 이와 같은 HPr-FruR간의 복합체 구조는 본 연구를 통해 세계 최초로 규명됐다.
□ 이번 연구를 통해 포도당, 과당 등 외부 영양분에 따른 세균 내 유전자 전사 조절 기전을 파악할 수 있었다. 이는 향후 영양분 조절을 통해 비브리오균의 병원성을 제어할 수 있는 연구에 활용될 것으로 기대된다.
□ 이번 성과는 영국 옥스퍼드 대학교에서 발간하는 국제 학술지 Nucleic Acids Research(IF 19.16, JCR 생화학·분자생물학 분야 상위 2.5%)에 3월 29일 자로 온라인 출판됐다.
※ 논문명: HPr prevents FruR-mediated facilitation of RNA polymerase binding to the fru promoter in Vibrio cholerae(비브리오 콜레라균에서 HPr에 의한 FruR 매개 RNA 중합효소의 과당오페론 프로모터 결합 억제 기작)
※ 논문 저자(소속, 역할): 윤창규 박사(서울대, 제1저자), 이승환 연구원(서울대, 제1저자), Jing Zhang 박사(KAERI, 제1저자), 이혜영 박사(서울대, 공저자), 김민규 박사(KAERI, 교신저자), 석영재 교수(서울대, 교신저자)
□ 한국원자력연구원 첨단방사선연구소 정병엽 소장은 “X-선을 이용해 콜레라균의 독성을 제어할 수 있는 현상을 규명했다”라며, “앞으로도 생물체 구성 요소의 방사선 반응 특성을 이용한 감염병 대응 연구에 힘쓰겠다”라고 밝혔다.


